许多药物发现计划经过多年昂贵的研究和开发却以失败告终,大部分是因为 2D 细胞培养和动物模型无法充分预测人类反应。而多器官芯片(multi-OoC)平台具有重新定义人类健康研究方式的巨大潜力。与单器官芯片或动物模型相比,multi-OoC 更能体现人类器官间串扰效应,可用于降低因跨物种转化差异而导致临床试验失败的风险,并可用于开发不适用动物模型的新的人类特异性疗法。此外,微流体技术的整合也为在精确模拟条件下模拟复杂的体内生理反应提供了助益。
构建 Multi-OoC 的最佳方法和环境
当创建 OoC系统时,生物工程师基本上是对人类细胞系统进行逆向工程,也就是说,拆开并分析生物系统的组成部分,确定功能所需的关键组织和组成部分,并利用这些发现来重建功能系统。要将实质组织(例如脂肪、肾脏、心脏、肝脏等)与生理屏障(例如血脑屏障、皮肤、胃肠道等)相结合,需要考虑的最基本问题是——从生理学和平台的角度来看,构建每个器官模型的最佳方法和环境是什么?例如实质组织最好使用 3D 培养方法建模,可模仿体内结构和复杂性,以及结合多种细胞类型。而生理屏障通常使用分隔装置,在多孔膜的不同侧培养不同的细胞类型。研究人员通过设计一个流入血脑屏障(BBB)-脑实质隔室-流出 BBB 的三耦合 multi-OoC(下图),模拟了精神活性药物甲基苯丙胺的血管内给药效果,并确定了 BBB 和神经元之间以前未知的代谢耦合。
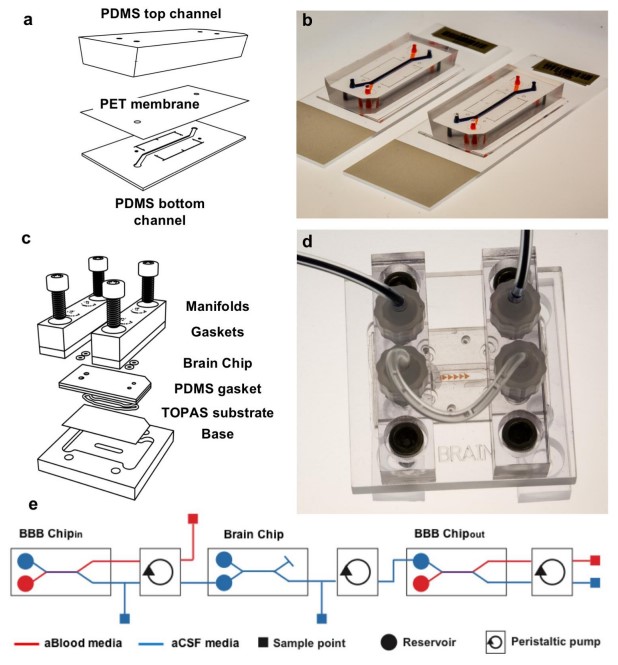 BBB -大脑三耦合芯片示意图[1]。
BBB -大脑三耦合芯片示意图[1]。
对于微流体设备来说,制造 multi-OoC 平台的材料选择至关重要。每一种用于平台制造的材料都有其表面化学特性,会影响细胞、液体和化合物与材料的结合或被吸收的方式。目前,聚二甲基硅氧烷(PDMS)仍然是学术界使用最多的头号材料,它具有透气性好、光学透明、易于加工的优点,其弹性特性对于整合阀门和泵以及机械刺激细胞也很是有利。然而,PDMS 作为一种多孔疏水材料,容易吸收疏水小分子(如药物和激素),并可能释放未固化的低聚物,从而干扰实验结果。近年来,已开发出许多用于 OoC 制造的非吸收性弹性体聚合物,例如,苯乙烯-乙烯/丁烯-苯乙烯聚氨酯弹性体[2]。还有一些其他有前途的替代品,如惰性热塑性聚合物(聚甲基丙烯酸甲酯,PMMA)、聚碳酸酯(PC)、聚苯乙烯(PS)、环烯烃(共)聚合物(COC/COP)、聚醚酰亚胺(PEI)和聚砜(PSF/PSU)等[3]。此外,3D 生物打印的出现允许在一个步骤中处理多种材料和不同的细胞类型,以产生精确控制的组织结构,有望提供更快的制造周期和更容易实现具有集成传感器的多材料平台(下图)。当然,材料的选择往往是在平台的需求和材料的可用性、经济性以及制造的可行性之间进行权衡。
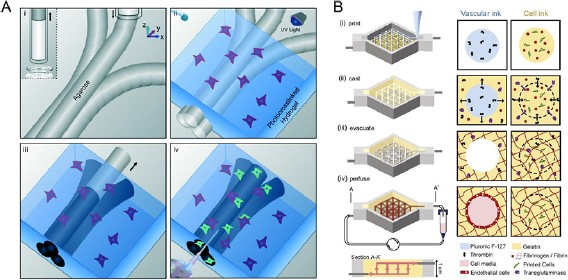 生物打印血管用于 OoC 平台[4]。
生物打印血管用于 OoC 平台[4]。
Multi-OoC 模型的耦合方式通常取决于研究目的。可以单方向灌注培养基以研究一种器官对其他器官的影响,或建立循环灌注以模拟交互作用,可更好地再现体内情况(下图)。一些 multi-OoC 设备,例如生理屏障模型,涉及两条独立的灌注线,这需要在平台中包含多个流体循环。多个模型的耦合必须正确设计微流体电路和灌注参数,以支持和测量器官间的通讯。具体而言,应优化流速以确保分泌因子达到给定的阈值浓度以影响下一个器官,并且是可衡量的。同样,在再循环回路中,需要调整培养基的总体积,以防止目标成分被大量稀释,同时确保有足够的营养物质可用并适当去除有害成分。
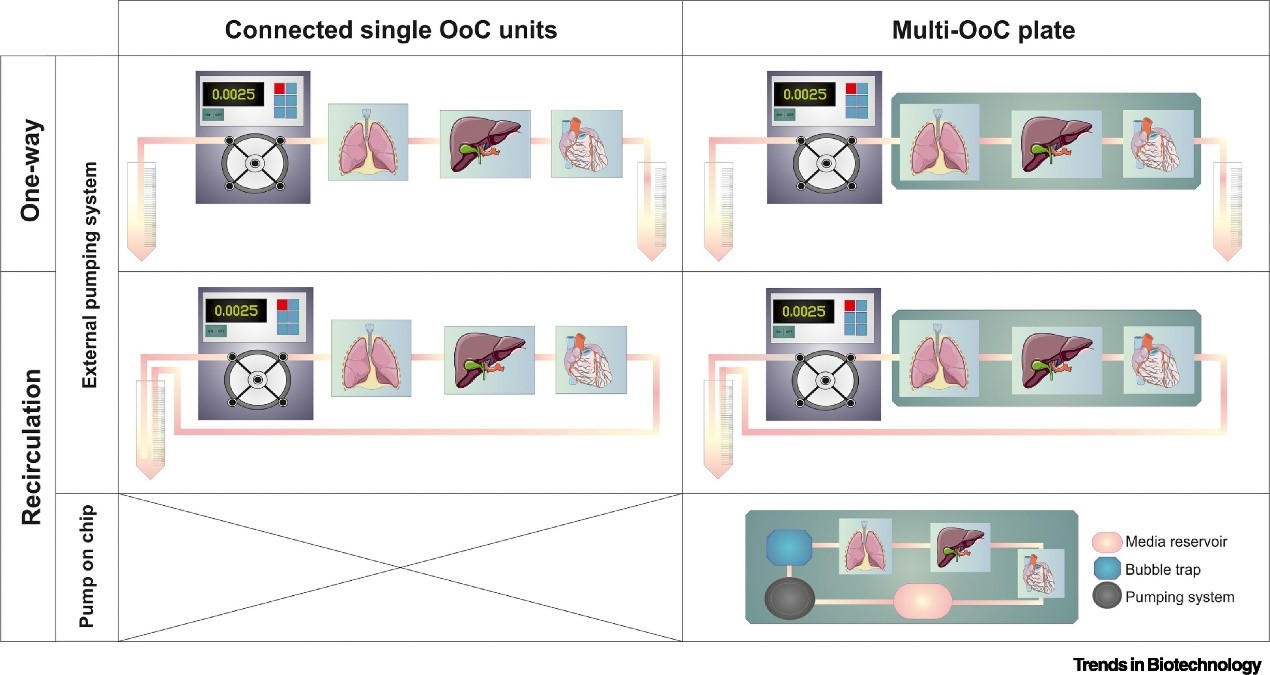 在 Multi-OoC 平台中建立不同器官模型之间通讯的各种策略。
在 Multi-OoC 平台中建立不同器官模型之间通讯的各种策略。
血管系统连接着人体内的所有器官,在每个器官的生理机能中起着至关重要的作用。很多疾病的病理发展通常以血管系统的改变为特征,例如,恶性癌症、心血管疾病、血栓形成、糖尿病、类风湿性关节炎和中枢神经系统疾病等。根据要建模的血管类型(从大型结构到毛细血管)以及研究背景,目前已经提出了不同的策略来设计血管系统。生理屏障中的内皮细胞,如血液-肺泡屏障、肠道和 BBB,通常是通过在多孔膜的一侧生长内皮细胞来创建的(下图A)。然而,这种方法并没有体现血管的内在曲率。相比之下,水凝胶或通道中的圆柱形结构包含了这种曲率(下图B)。在另一种方法中,可灌注的毛细血管通过水凝胶基质中内皮细胞(ECs)的自我组装产生(下图C),在可溶性因子的外部刺激下,如血管内皮生长因子(VEGF)灌注或由另一通道的成纤维细胞分泌(下图D),以产生复杂的三维血管结构。
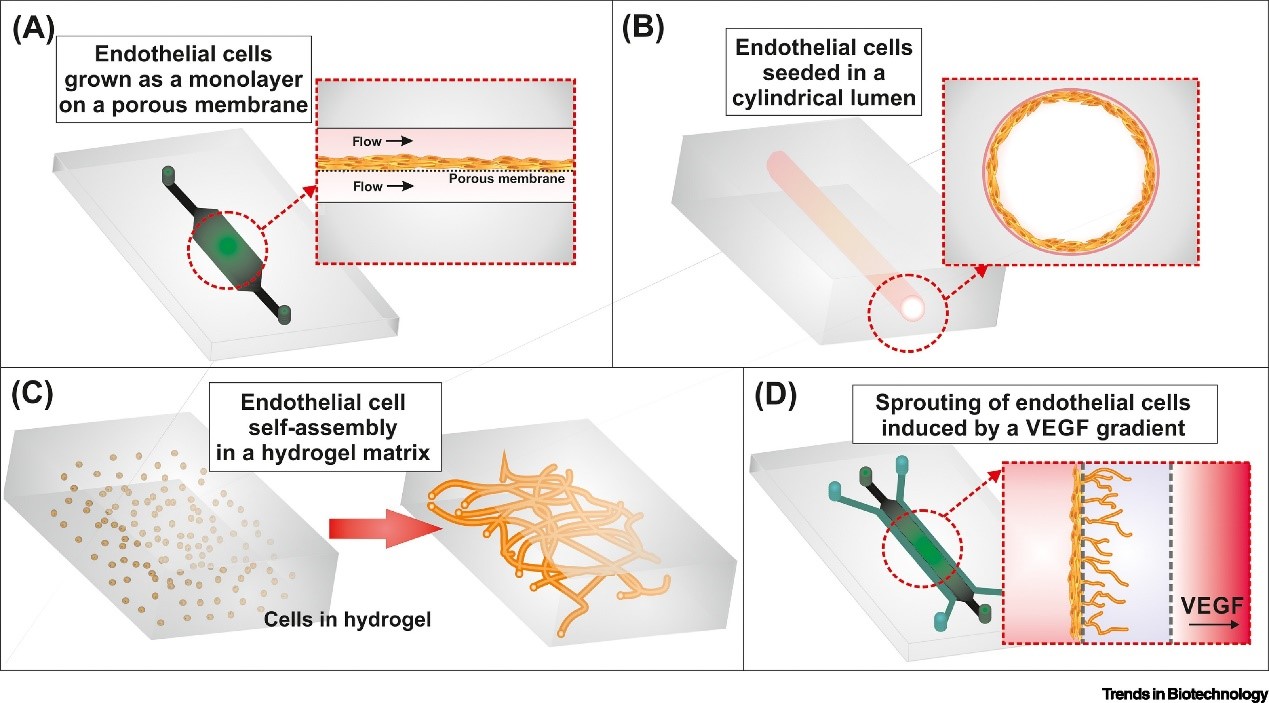 OoC 模型的片上血管化[5]。
OoC 模型的片上血管化[5]。
尽管已经为 OoC 平台开发了创新的血管化方法,但在 multi-OoC 平台中,“血管系统”通常仅使用管道来建模,不包括任何内皮。但血液和不同器官之间的所有分子交换都通过内皮发生。因此,可以使用成熟的人脐静脉内皮细胞 (HUVEC) 对内皮进行建模。表达与血管稳态调节相关的重要内皮标志物和信号分子。理想情况下,器官特异性微血管内皮细胞应能够用于真实地模拟每个器官的生理学。
器官在体内环境会不断暴露于各种刺激(机械、电、生物/化学等)之中,这些刺激对正常的发育和生理学功能至关重要。不正常的刺激会引发一些疾病,如神经退行性疾病、代谢性疾病和心血管疾病等。然而,这些刺激都很难纳入传统的体外模型,部分原因是它们具有脉冲性、慢性或周期性。使用微流控技术,几乎任何刺激都可以进行模拟,并能准确控制其时空特性。机械刺激的例子包括剪应力诱导的流动、表面应变、表面应变和液体流动剪切力的组合、压缩、以及压缩力和体积剪切力的组合等。电刺激通常由支持心脏组织分化和心肌细胞收缩的集成电极产生。如果是模拟荷尔蒙、化学刺激或接触药物、毒物,需要在灌注培养基中补充这些可溶性刺激物。
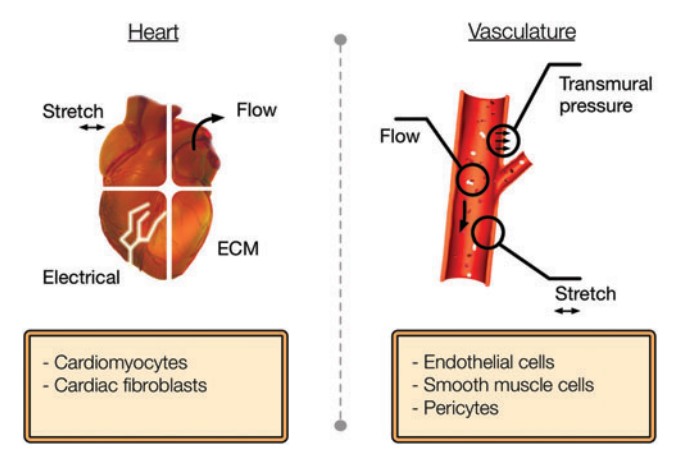 模拟心脏和血管所需的关键设计参数[6]。
模拟心脏和血管所需的关键设计参数[6]。
在过去十年中,OoC 领域在生物学和工程学的复杂性、生理学相关性的证明和应用范围方面取得了巨大的进步。这些进展也揭示了新的挑战和机遇,需要来自多个生物医学和工程领域的专业知识,以充分实现 OoC 在基础研究中的广泛应用。Multi-OoC 技术的出现使得可以在整个生物体的水平上模拟人体生理学,提供更出色的准确性和模型的复杂性。在这篇文章中,我们详细介绍了多器官芯片面临的挑战和未来,前面还介绍了多器官芯片的应用领域。目前的 multi-OoC 设备仅是对动物模型的补充,距离广泛应用还有很长的路要走。关键挑战仍然在于维持多个器官的稳态以及整合所有基本线索,包括激素刺激、免疫系统、淋巴、微生物组以及器官神经支配和血管化等。接下来,应通过集成多个传感器并耦合到光谱分析设备,在 multi-OoC 平台中实现多模态实时分析。未来,理想的 multi-OoC 系统应当是易于使用、即插即用、可根据目标应用按需重新配置、高度复用、全自动并与标准的实验室操作兼容,最终帮助改变科学、医学,乃至病人的生活。
参考文献
作为全球优质的器官芯片模型开发服务供应商,安必奇拥有丰富的体外模型构建、器官芯片开发等代理经验。我们的器官芯片模型基于微流控技术,具有微环境可控、测量信息丰富、成本低、自动化和高通量等许多优点。其中,肿瘤芯片在测试新的癌症治疗方法,尤其是与其它器官联合时,被证明是非常有效的。此外,还整合了全套的器官芯片构建、体外筛选技术一站式服务,致力于为国内外药物开发企业及机构的创新药物筛选提供高效的服务和解决方案。欢迎免费咨询!
24小时服务在线